寡核苷酸生产过程中的异常情况会导致形成常见杂质,例如缺失一个或多个核苷以及超过预期核苷酸 (N+1 , N+2 等) 的长链寡核苷酸,杂质性质与主成分非常接近,所以分离分析十分具有挑战性。
上一期我们探讨了反相离子对分离分析寡核苷酸。于此同时,由于寡核苷酸由于其带负电的磷酸骨架,可通过阴离子交换色谱进行寡核苷酸分析检测,基于带负电荷的磷酸糖骨架与带正电荷的键合固定相相互作用,目标分子吸附在固定相,通过增加流动相的离子强度使得寡核苷酸被洗脱,实现良好的保留和分离效果。所以离子交换色谱法是分离寡核苷酸的一种常用技术。

Shim-pack Bio IEX Q-NP采用聚合物材料,使得流动相耐受性更强,耐受宽pH值,无孔基质使得扩散更小,峰形更尖锐;键合季铵基团,独特的键合技术使得分离效果优异;良好的粒径均一性使得色谱柱柱效更高。
- 可实现寡核苷酸 n、n-1 良好分离分析
- 针对具有二级结构的寡核苷酸,具有独特的选择性企业性质
- 适用于硫代磷酸酯(PS)寡核苷酸的分离分析
- 对于PO杂质的分离分析展现优异的分离效果
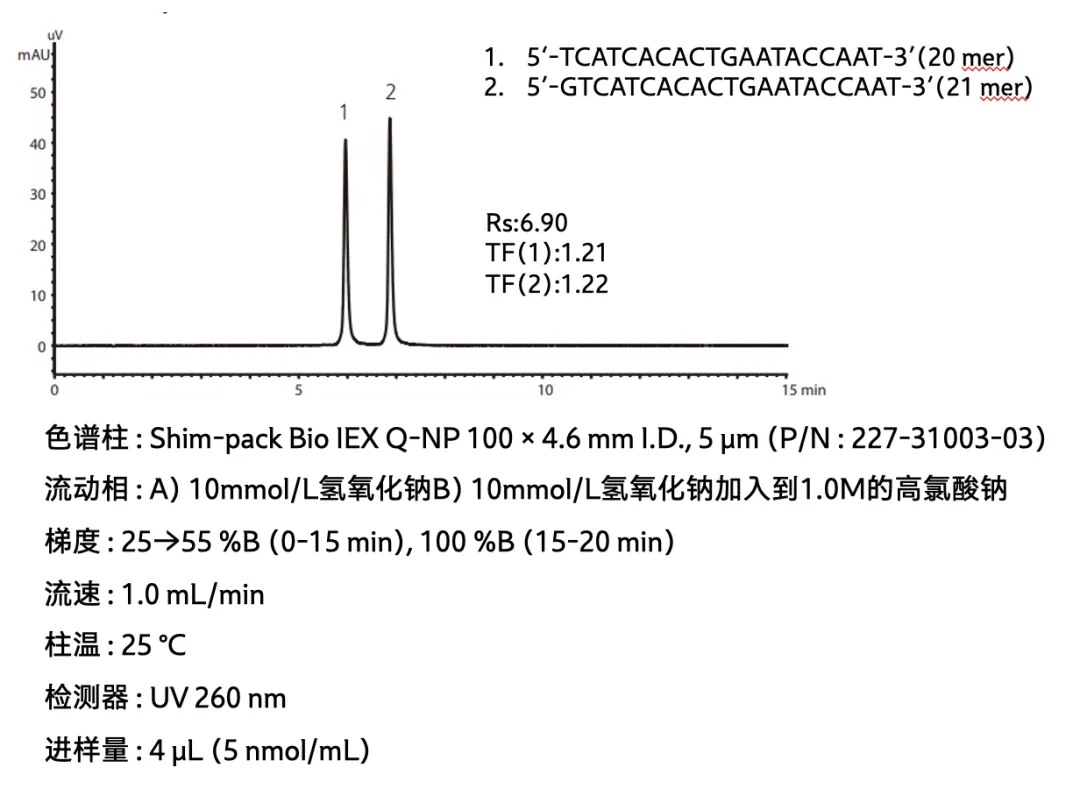
案例1:单链寡核苷酸n,n-1杂质分离
案例2:DNA片段杂质分离分析

色谱柱使用
注意事项
- 根据样品的吸附差异,在方法开发过程中可以不同种类的缓冲液和洗脱盐类型,因为它们都可以显著影响峰形和分辨率。 可以选择不同的pH盐,例如Tris-HCl 、NaOH缓冲液与NaCl或者NaClO4搭配使用。
- 一般情况下,目标样品以20 ~ 50 mM的缓冲溶液为弱洗脱流动相,此时通常样品待测物吸附到色谱柱上,然后通过盐浓度梯度(NaCl或者高氯酸钠进行洗脱,浓度一般通过梯度增加到0 ~ 0.5 M左右,有的时候可能更高),或pH梯度洗脱。 建议每次运行时用含有1m NaCl的缓冲溶液清洗色谱柱,以去除残留在柱上的杂质,这些杂质在最终流动相中没有被洗脱。
- 高pH条件以及高柱温可以有效提升分辨率。但是如果样品的稳定性较差,则推荐使偏中性洗脱液,温度40℃条件下分离
- PS修饰的寡核苷酸的保留大大增加,对于PS修饰寡核苷酸的纯化,高pH和离子强度有利结合分子的洗脱,洗脱流动相选择NaClO4更合适。 一般来说,通过离子交换进行生物分子的分离分析,采用的是水相缓冲体系,但对于寡核苷酸的纯化,对分离效率要求较高。在流动相中加入有机改性剂可以改变分离效果,一般不超过30%
- 不要使用含有氧化剂的溶剂作为流动相。
- 色谱柱保存在20 mM Tris-HCl buffer (pH 8.1)中
- 色谱柱柱温最高不要超过60℃使用,色谱柱耐受的pH范围是2-12。
- 脂溶性物质和弱极性物质可能吸附到色谱柱上,导致停留时间、峰形 和压力的变化。在这些情况下,按照程序洗涤色谱柱:依次使用
(1) 0.2 N NaOH水溶液/乙腈(80/20);
(2) 1 M醋酸水溶液;
(3)加入非离子表面活性剂的流动相;
(4)流动相为6m盐酸胍,依次冲洗4-5mL。每次冲洗溶剂注入清洗后,检查 保留时间和峰形是否恢复。

相关产品:


